3600
Câu 1: Chọn phát biểu đúng trong những phát biểu sau đây:
Correct!
Wrong!
Câu 2: Phản ứng: 2NO2
Correct!
Wrong!
Câu 3: Cho phản ứng: CuBr2
Correct!
Wrong!
Câu 4: Cho phản ứng thuận nghịch: H2
Correct!
Wrong!
Câu 5: Cho K1 và K2 lần lượt là hằng số cân bằng của hai phản ứng sau:
Correct!
Wrong!
Câu 6: Chọn phát biểu đúng: Phản ứng A
Correct!
Wrong!
Câu 7: Một phản ứng tự xảy ra có DG0 < 0. Giả thiết rằng biến thiên entanpi và biến thiên entropi không phụ thuộc nhiệt độ, khi tăng nhiệt độ thì hằng số cân bằng Kp sẽ:
Correct!
Wrong!
Câu 8: Cân bằng trong phản ứng H2
Correct!
Wrong!
Câu 9: Chọn ý đúng:
Correct!
Wrong!
Câu 10: Cho cân bằng CO2
Correct!
Wrong!
Câu 11: Xét phản ứng: CH3COOH + C2H5OH ⇌ CH3COOC2H5 + H2O; Kc = 4. Suy ra hằng số cân bằng của phản ứng thủy phân CH3COOC2H5 là:
Correct!
Wrong!
Câu 12: Chọn giải pháp hợp lí nhất: Cho phản ứng: N2
Correct!
Wrong!
Câu 13: Cho phản ứng: 2SO2
Correct!
Wrong!
Câu 14: Chọn ý đúng: Tác động nào sẽ làm tăng hiệu suất phản ứng: CaCO3
Correct!
Wrong!
Câu 15: Phản ứng N2
Correct!
Wrong!
Câu 16: Chọn câu đúng: Xét hệ cân bằng: CO
Correct!
Wrong!
Câu 17: Phản ứng thủy phân của ester: ester + nước ⇌ acid + rượu. Để tăng hiệu suất phản ứng
Correct!
Wrong!
Câu 18: Cho các phản ứng:
Correct!
Wrong!
Câu 19: Các phản ứng dưới đây đang ở trạng thái cân bằng ở 25°C.
Correct!
Wrong!
Câu 20: Chọn trường hợp đúng: Xét cân bằng:2NO2
Correct!
Wrong!
Câu 21: Phản ứng tỏa nhiệt dưới đây đã đạt trạng thái cân bằng: 2 A
Correct!
Wrong!
Câu 22: Chọn phát biểu đúng: Cho phản ứng: SnO2
Correct!
Wrong!
Câu 23: Quá trình khử thiếc IV bằng hydro: SnO2
Correct!
Wrong!
Câu 24: Chọn câu sai. Chất xúc tác:
Correct!
Wrong!
Câu 25: Cho phản ứng thuận nghịch sau: Co
Correct!
Wrong!
Câu 26: Khi hòa tan trong hexan, acid stearic xảy ra phản ứng chuyển hóa như sau: 2C17H35COOH
Correct!
Wrong!
Câu 27: Phản ứng tổng hợp amoniac: 3 H2
Correct!
Wrong!
Câu 28: Cho phản ứng: 2CO
Correct!
Wrong!
Câu 29: Ở một nhiệt độ xác định, cân bằng sau đây: N2
Correct!
Wrong!
Câu 30: Trong một bình kín dung tích 1 lít người ta nạp vào 1,0 mol khí A, 1,4 mol khí B và 0,5 mol khí C. Sau khi cân bằng Ak + Bk ⇌ 2Ck được thiết lập, nồng độ cuối cùng của C là 0,75 mol/l. Tính hằng số cân bằng.
Correct!
Wrong!
Câu 31: Ở 46°C, cân bằng N2O4
Correct!
Wrong!
Câu 32: Trong các phản ứng sau, trường hợp nào là hệ dị thể:1) C6H5ONa
Correct!
Wrong!
Câu 33: Dung dịch của NaCl trong nước nằm cân bằng với NaCl rắn ở áp suất không đổi
Correct!
Wrong!
Câu 34: Nước nguyên chất có thể tồn tại ở 9 pha khác nhau là: khí, lỏng và 7 dạng thù hình của nước đá
Correct!
Wrong!
Câu 35: Trong giản đồ trạng thái của một hợp chất được biểu diễn theo nhiệt độ và áp suất có xuất hiện điểm ba. Bậc tự do của hệ tại vị trí điểm ba này bằng:
Correct!
Wrong!
Câu 36: Tính bậc tự do của hệ sau khi đang ở trạng thái cân bằng ở điều kiện áp suất không đổi: CaO
Correct!
Wrong!
Câu 37: Chọn phương án đúng: Xét cân bằng: H2O
Correct!
Wrong!
Câu 38: Số cấu tử của hệ phản ứng: BaSO4
Correct!
Wrong!
Câu 39: Số bậc tự do của hệ phản ứng: Ca
Correct!
Wrong!
Câu 40: Chọn phát biểu đúng về tính chất của điểm ơtecti

Correct!
Wrong!
Câu 41: Chọn đáp án sai:
Correct!
Wrong!
Câu 42: Trong giản đồ pha sau, có bao nhiêu điểm ơtecti:
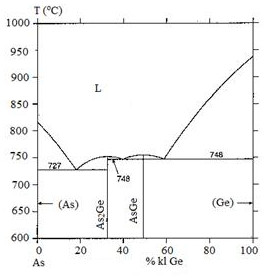
Correct!
Wrong!
Câu 43: Trong giản đồ sau có các vùng I, II, III, IV, V. Hãy xác định vùng kết tinh của rắn A.

Correct!
Wrong!
Câu 44: Chọn phương án đúng: Số pha của hệ phản ứng: BaSO4
Correct!
Wrong!
Câu 45: Chọn phương án đúng: Xét hệ cân bằng gồm ba chất có mặt trong phản ứng sau: CaCO3
Correct!
Wrong!
Thi thử bài tập trắc nghiệm ôn tập môn Hoá đại cương online - Đề #7
Thi thử bài tập trắc nghiệm ôn tập môn Hoá đại cương online – Đề #7 nhanh tại ‘Hoá đại cương’ chỉ có tại Tracnghiem123. Đảm bảo nhanh chóng và dễ dàng để bạn có thể tự kiểm tra kiến thức của mình một cách hiệu quả. Hãy tham gia ngay!

